做动物实验,最先要做的事情就是要养好动物。掌握好动物饲料、饮水及其生活环境,这对于动物实验的成功是最基本的保证。这是看似一个平常,但却有着不少细节的问题。主要包括以下几个方面:
第一,实验动物的选择概述
第二,实验动物如何辨雌雄
第三,实验动物的适应性饲养
第四,实验动物的饲料(普通饲料、特殊饲料)
第五,实验动物的饮水
第六,实验动物的笼具
第七,实验动物的垫料
第八,实验动物的饲养环境
第九,实验动物的护理(造模后)
第一,实验动物的选择。
实验动物如何选择?这个问题对于药理和实验动物专业的朋友来说,不是难事。但对于需要做动物实验的其它专业的朋友来说,有时候会感到茫然。或者没有自己的思考,照抄别人的做法。对于这一部分站友,我们不可能要求去系统学习《医学实验动物学》,但我们可以常备一本在身边。在需要用的时候翻一翻,将会使你豁然开朗。因为书中比较详细地介绍了常用实验动物的解剖生理、生物学习性等等,最主要的是它为你选择什么样的实验动物提供了重要的参考。
因此,系统学习或者零星地翻阅《医学实验动物学》是保证合理选用实验动物的基础之一。再者就是要参考大量文献。在此,我不想对这一问题全面展开,只是提几点原则和方法。
第一,做什么样的实验?什么动物适合本实验?
做什么实验,这是选题时就确定好了的。肯定是经过论证的。无需多讲。用什么样的动物呢?我想,大多是参照文献,再结合自己对实验动物的了解。选题之时就肯定阅读过很多文献了,因此不会陌生。如:做高血脂、动脉粥样硬化,我想大多数人会选择大鼠、兔子,也可以选金黄地鼠、鹌鹑,少数人会选小鼠,但我想用狗和猴的基本上不会有吧。因为要选择比较容易形成此疾病的动物,且要易得。所以,对于不太熟悉的人来说,要多看文献,参考别人是如何选择的。就算是对动物比较了解,系统学过这方面知识的,也要多看文献,综合权衡。切忌随意地凭空想像。
第二,采取什么样的方法造模?
做动物实验通常是要造模的。选择什么样的方式?这要从实验的目的及条件入手。造糖尿病,可以用手术,也可以用药物。其中药物有四氧嘧啶及链脲佐菌素(STZ)。后者用得较多,且为国际认同。而四氧嘧啶目前用得较少了。造模方法一是参照《药理实验方法学》,二是参照文献。造模方法有时也决定了你的动物选择。像做手术造动脉粥样硬化,我想用大鼠比小鼠来得方便吧?
第三,经费承受能力如何?
做实验也要精打细算。不可能为了所谓的高水平、高端技术而不顾实验室的条件。像做高脂动物模型,假设经费只有一万多元,一定要弄个敲除APoE基因的小鼠来做,恐怕没人认同。做一个简单的镇痛抗炎实验,你非得要用SPF实验室,这也是不太实际的,也是没必要的。就像一个刚刚能满足温饱的人突然要花上很多钱去国外旅游一样,是不切实际的。因此,实验经费让我们有时不能达到理想的状态。但是,科研并不一定是要用高端的技术、高级的动物,而是要能解决问题。能用简单的技术、普通的动物解决问题的,就不必去盲目追求更高。过于理想化、不考虑经费问题,是不少研究生初涉实验时的通病。
第四,多了解一下实验中可能出现的问题。有不少人做实验时根本没有考虑可能出现的失误,因而在实验出现问题时茫然无措。即使是造同样的疾病模型,不同的动物表现可能有不一样的地方。要对这些问题有充分的了解,并要进行必要的预试。要了解动物的习性,并进行必要的护理。
因此,在你决定了选择何种动物,以何种方式造模之后,实际上,你就要对整个实验过程有全面的计划,并对可能出现的问题有应对的措施。 第二,实验动物如何辨雌雄?
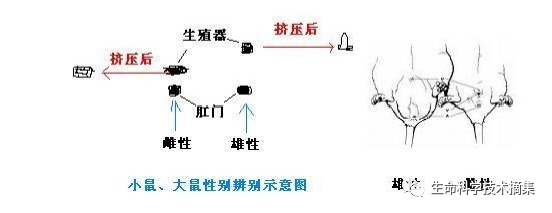
这个问题应该是每个初涉动物实验的人完完全全掌握的,是不容许有任何一点差错的。如何辩?当然是看生殖器了。一般大动物好辩,像狗,猴等;小动物及中等大小的体型的难辨一点,如:小鼠、大鼠、兔。可有下列方法来鉴别:
1. 看肛门与生殖器之间的距离:雄性隔得远,雌性隔得近。雄的生殖器与肛门间有阴囊,不过幼龄时不太明显。
2. 雄性阴茎朝头的方向突出,可轻轻挤压包皮使其露出而确认。雌性较小时可见闭合的阴道口,挤压亦可张开。像兔、豚鼠等,阴茎短小,故较难辨认。最好是挤压生殖器以确认。看得熟练了,其实也不难。生殖器处呈O型者,为公的;生殖器处呈V型,下端裂缝延至肛门者,为母的。这主是针对幼龄的动物而言。
3. 看乳头或睾丸。成年的动物比较好辩认。母的有乳头,雄的有睾丸。但在比较小的时候,乳头,睾丸并不是那么明显的。
辨雌雄的目的就是为了分笼饲养,避免雌雄同笼而交配,无法进行实验。不过,即使是同性的放在一笼,有些细节仍值得注意。
说一个小插曲:本人有一次将两批做实验剩下的小鼠弄到一个笼里。结果发现大的小鼠不断追逐小的小鼠,且试图交配。一师妹在旁说,是不是我弄了只雌的进去了?我仔细检查了一下,根本没有弄错。放回去,过了一会儿又发现如此现象。后来我想可能是因为大的小鼠(25g~30g)已完全性成熟,在找不到雌性的情况下来追小的雄性小鼠(15g~18g)以获得性的满足。这岂不成了“同性恋”?因此,动物的日龄相差太大的不要放在同一个笼里,以免发生上述现象。当然,一般而言,一个笼子养多个动物的主要是小鼠、大鼠、豚鼠、金黄地鼠等小动物,像兔子、狗一般都是一个笼子一只。
刚开始一定要认真仔细地观察,这样会有一些经验。熟悉以后,可以很迅速很准确的分出来。对初学者而言,我建议用第2种方法予以确认。
一般提供商将动物送来时,都是已经分好了雌雄的。但我们仍要亲自进行确认。一旦有一只混入异性群中,可能给实验带来极大的影响,甚至前功尽弃。
第2种方法的示意图如下:(不仅是大、小鼠,也适合于兔、豚鼠等的性别鉴定)
 第三、实验动物的适应性饲养
所谓适应性喂养,是指实验动物由繁殖地或供应商处搬到实验动物房以后,在实验之前,为了使之适应环境而喂养几天的过程。这一过程非常重要,却往往不受人重视。
这一过程一般至少为期三天,最好是一周。
为什么要进行适应性喂养?
第一,因为动物从一个地方进入到新的环境之后,它们要自行调整一下,才能适应。就像中国队员到外国踢足球要倒时差一样,动物们也要调节调节。因为运输、转移过程中,动物原有的自身节律受到了影响,需要恢复或适应新的节律。
第二,在适应性喂养期间可密切观察动物是否健康?如果动物运来之时就带有疾病,则可能在此期间表现出来。这让我们对此有一个缓冲期。不至于拿有病的动物匆匆忙忙在做实验。虽然不是所有有病的动物都在这几天看得出来,但这几天确实给了我们一个重要的参考。
怎样使之适应?
第一,配置好饲料、饮水、垫料,做好通风,12h-12h明暗交替。努力使之在“新家”舒服地过好日子。
第二,密切观察其毛发、排泄物、活动情况。这是考察动物是否有病的外在表现。
第三,注意与实验室原有饲养的动物隔开一定的距离。其它动物的声音、排泄的氨对新来的动物有一定的影响。
如发现动物有个别状态不佳者,应立即隔离,并分析原因。有三分之一以上状态不佳者,高度怀疑动物有疾病。有死亡者,高度怀疑此批动物有问题。
适应性喂养,是保证实验成功的前提之一。在此期间发现动物有病者,应更换别的批次动物。也有的是实验动物体重尚达不到实验所要求的大小,这种情况下可适当延长适应性喂养的时间。
第四、实验动物的饲料。
饲料是一个很重要的方面。我们要了解常用实验动物基本的饲料组成。同时,也要了解造一些疾病模型所需的饲料组份(如:高脂模型,缺铁性贫血模型等)。因此,下面分普通饲料和特殊饲料两部分来讲。
A 普通饲料
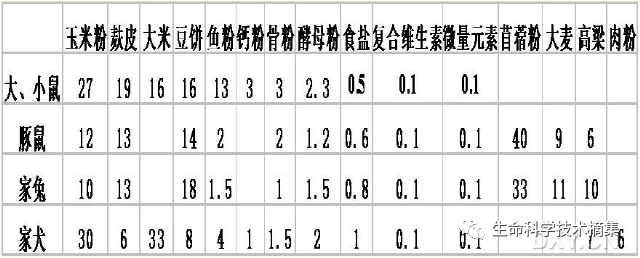
以常用的实验动物为例,我们来讨论一下它们饲料的组成。
一是小鼠、大鼠的饲料。以玉米、大豆、麸皮、鱼粉为主,辅以复合维生素、骨粉、微量元素。一般做成长圆柱状形。或曰粗棒形。直径在1cm左右。这样的饲料又称为颗粒饲料(本人觉得此名称不妥,是否可称为“条状饲料‘、“棒状饲料”?)。颜色一般为大豆黄色。小鼠、大鼠的饲料为全价饲料,即不需要再添加任何营养成分。
二是豚鼠、兔子的饲料。以苜蓿、玉米、大豆、麸皮、鱼粉为主,辅以复合维生素、骨粉、微量元素。与小鼠、大鼠的饲料相比,主要是苜蓿的比例达到了40%左右。一般做成细长圆柱形。或曰细棒形。直径在0.3cm左右。颜色呈带一点斑驳的青色。豚鼠、兔子的饲料成份基本一样,只是比例略有不同,一般可以共用。因二者不能自身合成维生素C,所以苜蓿粉的比例较大。但,饲料是加水润湿后,经高温高压而制成,维C及酶类等已部分破坏。豚鼠、兔子饲料不是全价饲料。因此,在饲料之外,仍要加少许青菜或青草,否则有的状态不佳甚至死亡。本人也曾用在饮水中加维C片的方法,但效果似不如直接给予青菜。
三是狗的饲料。以肉粉、玉米、大豆、麸皮、鱼粉为主,辅以复合维生素、骨粉、微量元素。有膨化饲料。一般要增加肉类食物。
四是猴的饲料。猴为杂食性。喂以混合精饲料并辅以苹果、葫萝卜。混合精饲料组成:玉米粉60%,谷粉20%,面粉15%,黄豆粉5%,再加上骨粉、鱼粉、糖、食盐、维生素等。幼龄动物通常要加上奶粉。以前常以上述组分加水混合,做成块状,烘干,但现在有膨化颗粒饲料出售。
对于小鼠,每日的饲料在4~8g,大鼠在15~20g;豚鼠在15~30g。兔在30~80g/kg/天。注意他们的啮齿类动物行为,就是喜欢咬东西。因为它们的牙齿终生生长,于是它们要磨牙。这样,投予过多饲料它们也会浪费掉。兔虽属兔型目,但有类似啮齿目动物的行为。
下图中所示是一些实验动物饲料配方的百分比(%)。
B 特殊饲料
这里主要是指一些用于造模的饲料。
1 高脂饲料
这可能是最常用的一种造模饲料。主要原理是通过外源性胆固醇、甘油三酯的摄入形成高血脂、动脉粥样硬化动物模型。最常用的动物是大鼠、兔、金黄地鼠。也有用其它动物的,但通常以糊剂、乳剂灌胃来造模。
下面我们来谈谈高脂饲料的配制。
常用配方:猪油 10% 鸡蛋黄 5% 胆固醇 1~2% 丙基硫氧嘧啶 0.2% 普通饲料 82.8~83.8% 另可酌加胆酸盐 0.2% 左右,维生素D3等。
原理:猪油富含甘油三酯;鸡蛋黄是天然食物中含胆固醇最高的;丙基硫氧嘧啶有助于成模,因甲状腺素促进胆固醇的分解,而丙基抑制其作用;胆酸盐主要是促进胆固醇的吸收;维生素D3主要是促进动脉粥样硬化形成。
制法:胆固醇鳞片状,研细;丙基研细;二者充分混合。取鸡蛋煮熟,剥取蛋黄,捏碎,吹干,研成细粉,与前二者混合好。如要加胆酸盐、维生素D3,亦将其混合好。然后以“等量递增法”将上述药料加入到普通饲料粉末中。再将猪油化开,喷洒在饲料粉末之中混匀。混好之后喷适量水为黏合剂,加到制粒机中制成棒状饲料。
在此,特别提出“等量倍增法”。因上述造模药料与普通饲料的量相差悬殊,直接加入其中是难以混匀的。这样会造成以后动物摄入的造模的胆固醇,甘油三酯差异大,不利于实验。所谓“等量递增法”就是:将上述药料入差不多相等的普通饲料粉末充分混匀;得混合物后,再加与此混合物相等量的普通饲料混合,充分混匀;如此类推。比如:药料为200g,第一次混合后即为400g,第二次混合后为800g…这样就成倍地混合好。因此,又称为“等量倍增法”。因为相等量的不同物质混合时,相互混入对方的机率最大,最容易混匀。学过药剂的朋友们是非常熟悉的,这在中药的散剂中就是这样做的。没学过这个方法的朋友要特别关注。
目前有些饲料供应商称可以提供现成的高脂饲料。一则他们很多根本就是胡乱地加入其中的,极不均匀,严重影响实验。二则他们做的饲料中造模药的比例不一定符合你的要求。很少有人懂得“等量倍增法”的原理及实用价值。因为目前饲料行业中专业人士多不会在一线,而是做管理工作。做饲料的多是没有专业知识,而只是稍加培训甚至没有培训的普通工人。当然,“等量倍增”的做法很简单,关键是要有这样的专业意识。做此饲料时,最好全程跟踪,这样才会对实验结果心中有数。
在此,我一而再,再而三地强调“等量倍增法”配制饲料,就是为了站友们减少在此类实验中的误差。因为,有人问我,为什么他们的高脂组有些动物的血脂几乎跟正常组没有显著差异,而有的又高很多,标准差如此地大?我第一时间想到的就是饲料的配制是否有问题。如果饲料没配好,实验可能前功尽弃。
因此,不厌其烦地说两句:高脂饲料要亲自配,且按要求、按科学规律配(等量倍增法)。
饲料成形后,要摊开置通风处吹干,或以电风扇吹干。不要受热。在春夏之季,尤应注意。因其中含有脂肪油类,且因制饲料时要经过高温压制,放在一起易发热、生霉。有人置冰箱保存,实不妥。一则冰箱容量有限;二则饲料中的水分未尽,出冰箱后,冰化,更易生霉,且动物不是太喜欢吃冷藏后的饲料。一次配制饲料不宜过多。一般可配实验全程所需饲料的一半。后半段根据前面所消耗的实际量来酌性增减。但需给足量,宁多一点,不能少。
高脂饲料比普通饲料要软,易碎。要注意轻拿轻放。底部碎屑可收集起来,再压制成型。
2 缺铁性贫血饲料
3 缺锌饲料
第五、实验动物的饮水
下面我来介绍一下实验动物饮用水的要求,以及饮水器具。
A 饮用水
实验动物级别的不同,饮用的水也不同。
通常情况下,普通级动物饮水达到生活饮用水标准即可。
清洁级、SPF要求灭菌。可高温高压灭菌,也可以加次氯酸钠,或以盐酸调PH到2.5~3.0。后者又称之为酸化水。
无菌动物饮水只能高温高压灭菌。
B 饮水器具
一般有连通器式自动饮水器和简易的饮水瓶。前者多为一些有条件的实验室所用。而后者则是多数实验室常用的。对某些动物,用饮水瓶效果还好一些。下面就介绍一下饮水瓶。
饮水瓶有一个金属嘴,嘴上套有一个金属外壳及橡胶塞,再就是无毒塑料瓶身。金属嘴多为不锈钢,前端圆滑,便于动物对吸。瓶塞的外壳多为铝皮,是为了防止动物啃咬,因啮齿类动物及兔常有这种行为。胶塞一般为绿色,是无毒的。
饮水管理注意事项:第一,装水时,不可装到全满,否则因大气压的原因,水出不来。第二,勤换水。最好是每天一次。换水时,要清洗瓶身内部及瓶嘴。因动物喝水时,可将口中的微生物回送至瓶内,尤其是在瓶嘴内面。第三,一般水瓶要消毒后再使用。但目前在普通级动物房很少有人做到这一点。换水是一项枯燥的工作,但也是饲养动物,做实验的最基本的前提。看到有些研究生在这方面做得极不规范,更有甚者,饮水瓶里竟然有绿霉,还让动物饮用此瓶中的水。第四,要注意是否漏水。漏水则有可能将动物淹死(主要是小鼠)。盖好瓶塞后,一定要看一看。确认无事方可离开。
 第六、实验动物的笼具
常用实验动物的笼具有小鼠笼,大鼠笼,兔笼、狗笼、猴笼。其中,以前三者较为常用。下面着重介绍一下。
小鼠、大鼠笼比较类似,所用材料也一样,只是尺寸及式样上有所不同。
笼具有两种基本类型:一种是整体结构的固定底板的塑料笼箱,上面加盖金属网盖;另一种是有活动底板的笼箱,底部由金属网构成,再加一个活动底盘。这种笼具的优点是:粪便直接落入底盘中,清洗方便。但这种笼具一般是不加垫料的。对动物的保温有较大的影响,目前用得不多。主要用的还是前一种。
笼具箱一般由聚丙烯塑料制成,呈不透明的白色。坚固,耐高温。现在有透明的聚碳酸酯塑料笼出现。两端有一突出部位供与网盖嵌合。笼具箱四个底角一般是圆滑的,这样,换垫料的时候就不至于有死角难以清除。小鼠笼箱两种:一种是上部为水平的;一种是上部其中一端为斜面。大鼠一般为水平的。如图所示。
关于金属盖网需要注意的问题:金属网盖要看其是否有足够的硬度及韧性。网盖能否与箱体紧密相扣?金属丝之间的距离是否合适?尤其是养小鼠的笼盖,如果有较大的网眼,小鼠即可跑出来。这一点要特别注意。不然,一会儿功夫,你就可以看到小鼠满实验室跑的壮观场面。而对大鼠而言,要注意把盖网与箱体嵌紧,必要时要适当负重。因为大鼠劲大,有时可顶开盖网跑出。
小鼠、大鼠笼的金属网盖一端有一个凹的楔形槽,中间以挡板隔开,一边用来盛饲料,一边用来盛饮水瓶。如下图所示。值得注意的是,放饲料时要注意,不要用手直接触到那个槽的底部,因为老鼠可能会把你的手指当饲料咬。同样,你清除槽内的剩余饲料的时候也应注意这一点。
兔笼一般多为集中在一起的金属网,有一个供饮水的装置。下部为金属丝网,无垫料。在丝网下置有一层接粪便的金属垫,都是多个连成一体的,这样便于冲洗。
狗笼如图所示。
猴笼如图所示。与狗笼大体相同,不过较大一些。
此外,还有羊笼、鹌鹑笼等。
上述笼具只是最基本的。是实验笼。还有运输笼、繁殖笼、具有独立送风系统的笼具(IVC)等等。想了解更多的话,参见专著或一些提供商的网站。像苏州等地就有不少这样专门制造笼具的企业。
笼具是随着时代的变迁而不断变化的。新中国成立之初,有些动物就是养在陶罐里的。而现在,笼具取得了长足的发展。一是高分子材料的发展使得笼具有了更多的选择;二是层流技术使得实验室的局部调控和微观调控成为可能;三是广大科研工作者在实践中提出了客观的要求。这样,笼具产业就不断地发展。笼具越来越先进,也越来越奢侈。
我们在实验中发现一些问题或缺点,可及时反映给提供商,以便逐渐改进。

第七、实验动物的垫料
垫料向来是一个不引人关注的问题。但实际上也不可忽视。有些实验可能就是因为垫料的问题而导致失败。
所谓垫料是指垫于笼具底部用于动物保温、吸水、做窝等作用的物质。
目前我们所用的大多数垫料是家俱厂的刨木花。
一是要注意刨木花的种类。不是所有的木材形成的刨木花都可以做垫料。松树等针叶林类的刨木花多含芳香类物质,对肝药酶有一定的影响。进而影响到药物的生物利用度、生物转化等。对实验结果产生无形的影响。
二是要注意其片型大小。太大或太碎的都不行。太大则笼具底垫不匀,太小则容易引起动物的肺部疾病或不适。因目前垫料生产不规范,多为家俱厂副产品。有的里面竟会有些小的木头,有的还有厂家的生产计划等废弃资料,有的有大量很细的锯屑。这些细的锯屑易产生扬尘,影响动物的呼吸系统。
三是吸水程度。垫料主要是给动物一个生活的微环境,有一定的保温作用,同时也起到吸收粪便中的水分的作用。通常我们决定什么时候要换垫料就是看其被尿浸湿的程度。从某种意义上来说,垫料即是动物的“尿布”,只是比尿布的功能更多一点而已。吸水不好的垫料使得我们要频繁更换,且对动物不好。
四是是否消毒。按规定,垫料都是要消毒的。因为其中可能有昆虫,微生物等。而动物的粪便等混在垫料中,加之适宜的温湿度,将会成为微生物等良好的滋生场所。所以要消毒。但目前很多地方做不到这一点。很多都是动物供应商与家俱厂联系好,直接去取。而家俱厂亦只是把这些东东当作仍可利用的“垃圾”而已。垫料的规范意识一定要提高。家俱厂要经过适当的挑选,并经过一定的程序,才能提供合乎规定的垫料。
除刨木花外,还可以用稻杆等物质来制成。国外多用玉米芯打碎。可以因地制宜。新的垫料正在研究中。但,惜因大家对垫料质量不重视,二则利润不乐观,目前垫料的生产存在不少问题。希望能在不远的将来有所改观。

第八、实验动物的饲养环境
这里所指的环境包括动物在笼具这个空间的微观环境、整个动物房的局部环境、以及动物所在地的大环境。
小环境主要影响因素是:垫料、饲料、饮水、笼具、每笼饲养数、排泄物等。
局部环境主要影响因素是:温度、湿度、换气、气流、氨浓度、其它有害气体、粉尘等。
大环境主要影响因素是:气候、昼夜节律等。
对我们而言,大环境是已经基本确定了的,我们是基本不可能改变的,所以不在此探讨之列。
小环境中的饲料、饮水、垫料、笼具我们已分别讨论了,不再赘述。
下面来看看其它因素。
小型实验动物如:小鼠、大鼠、豚鼠常每笼饲养多只。每一笼该饲养多少合适?有人研究发现,每种动物都有一个适合生存的最小平均空间。低于这个空间则出现一些相互攻击、易致病等一系列不良现象。
以目前国内常用的笼具而言,小鼠笼每笼饲养10左右为宜,最多不超过12只。大鼠笼每笼饲养5只为宜,最多不超过7只。豚鼠有的置于兔笼中,也有的在大鼠笼中,一般以3~4只为宜。兔、猫、狗等,一般都是每笼只养一只,且有专门的笼具。
动物的排泄物有尿、粪。主要是尿对动物生长影响较大。因为尿中有氨类,可挥发到空气中,浓度过大则影响动物的生存状态。因此,粪便要及时清理。对于含有固定底板的笼具而言,换垫料就可以清除粪便。对于有活动底板的笼具而言,抽出底板盘冲洗即可。对普通动物,换垫料可以视情况两到三天一次。主要是看垫料被浸湿的程度。对于糖尿病的动物,常常是一天一到两次。活动底盘的笼具主要是清洗排泄物较方便。但目前使用不太多。
局部环境是实验动物生存的空间,也是实验成功与否的前提之一。在此,不讨论SPF实验室。因目前在国内,能真正用上SPF实验室的并不是很多。许多实验室用的还是清洁级环境,有的甚至还达不到此标准。
温湿度是最基本的指标。一般实验室要配备温湿度计。温度一般由空调来调节。湿度呢,稍难一点。空调有除湿的功能,湿度过大可在一定范围内调节。但有时调不了。我的办法就是:加开风扇。风扇可使室内空气对流,并通过排风扇将湿气送出去。如果湿度过小,就在地板上酒上一点水,使之蒸发到空气中,提高其相对湿度。温度呢,大鼠最适温度一般在26度,小鼠21~23度左右。湿度一般控制在50~70%,最好是在60%附近。
关于换气,主要是通过排气扇了。一般我基本上开着不停。因为有两个,有时会停下一个稍微休息下。因为长期开着可能引起发热损坏,以及引起线路起火。建议一天要开18小时以上。
目前国内的很多动物房不规范。对实验动物的环境不够重视。对实验动物房的投入严重不足。不少做动物实验的人员对实验动物的知识了解不够。这些情况的改观有待时日。
不管如何,我想即使条件不足,最基本的几条是要的:温湿度控制、做好换气、尽量减少粉尘、及时换垫料。此外,除称重、给药等基本操作外,不要在动物房进行手术等其它实验操作。有些实验场地不足的地方挤在一起,一边养动物,一边做实验,这是不妥的。一则是取血、手术等将会引起其它动物的恐慌;二是在动物房进行操作影响实验结果。因为氨、粉尘及其它物质可能干扰实验。
排有害气体主要靠通风换气。对悬浮的粉尘,一是对可能引起扬尘的物质的控制,如:垫料;二是能有层流技术最佳。但据我所知道的情况来看,SPF实验室可达到此标准。但以下标准的实验室,多数还是达不到。所谓的清洁级实验室,只是条件控制得相对好一点。属于普通实验室里的较高水平而已。究其原因,主要是当前做“活性”成为科研中的流行曲。许多非药理的科研者各自建立所谓的“活性筛选”实验室,杂乱地配置动物房,根本没有按一定的标准来建设。就算是药理的人员,也有不少囿于经费,或者对动物实验室不够重视,而粗糙地建立动物房。
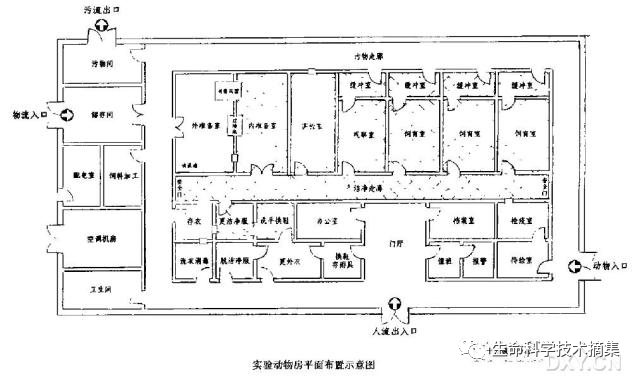
下图所示为清洁级动物房的设计示意图。其主要原则是:人流与物流分开,即人员进出通道与动物、饲料等其它物品的通道分开;逐级控制,主要是控制空气中的粉尘及菌落数。
第九、实验动物的护理
在药物造模或手术之后,动物往往会有一个危险期。这一时期需要我们的精心护理。如有不慎,则可能造成死亡,或者状态不佳,影响后续实验的进行。因此,我们要来谈一谈护理的问题。
一是术后可能的感染及其应对措施。
术后一般要保温24小时。并必要时注射青霉素等抗生素。当然,如果本身就是造成感染模型,用药物干预看其效果的话,则不能用除干预药物以外的抗生素了。
二是造模后的危险状态及其应对措施。
如:糖尿病模型的前三天。糖尿病造模后有一个低血糖时相。是因为胰岛大量破坏后,释放出大量胰岛素至血中,引起低血糖。必要时要使动物加葡萄糖。使之渡过危险期。
如:急性肾衰模型,或一侧次全切除的慢性肾衰模型等,都要密切观察。
总之,影响肝、肾、脑、心等重要器官的急性造模的动物,要多多注意。
三是密切监测。
动物出现状态不佳基本上是两种原因。一是动物本身的休质。有的动物在搬进实验动物房后,由于适应性的问题,可能出现体质有所下降。二是造模后形成的。多数动物实验是要造模的,造模是人为地引起疾病,对动物的损伤较大。因此,日常的监测是不可少的。有的只需观察,有的要采取一定的措施。如:隔离观察、抗感染。
也许大家想像不到,就养普普通通的动物,还有这么多的道道。的确,要做好一个动物实验,你首先就要做一名优秀的饲养员。也许有些实验室有专门的饲养员,我们不必为这些琐事而费去不少时间、精力。但是,如果你不对这个过程有所了解,对关键的步骤不加以跟踪,到时候实验出了问题你会感到很茫然。就像作一个建筑的工程师,也许你不需要亲自去打桩、砌砖、架梁,但你必须去监测、去检查,做到心中有数。但我提倡研究生们最好是一切过程都亲自动手,力争做到全局了解,并培养吃苦耐劳的精神。
养动物,是一门科学,也是一门技术。是实践与理论相结合的产物。虽然我们很多人系统地学过《医学实验动物学》,但在实际中遇到一些问题却不一定能及时找到答案。因为动物的变异很大,出现的问题也会是多种多样的。这就需要我们的探索。亲自饲养、密切观察,能够使我们在实践中又加深对理论知识的理解。
当前,做“活性”、“药效”成为一种医药学科研中追求的倾向。医药学的研究生们为了使自己的论文增色,往往都去做一点“活性”来装饰门面。临床专业的、药化专业的、药动专业的、生药学专业的、炮制专业的、生化专业的、中药化学专业的、药分专业的、药剂专业的、化学合成专业的等等,几乎现在所有的相关专业都想要做一点“活性”。动辄就是细胞实验、动物实验。但我想,又有多少人是真正懂得该如何做的?不仅是药理、实验动物专业以外的,就算是专业内的人士,也并非全部能做到规范、合理。且,药理实验、动物实验又是非常广泛、繁杂的,能够比较熟练的往往只是一方面的实验,对其它方面了解甚少。每一个实验又有它不同的特点,能做好甲实验,不一定能做好乙实验。因此,做动物实验不是一件容易的事情。而当前,对药理的研究生培养方面又有着多少的缺陷?甚至有的药理研究生都没有学过《医学实验动物学》这样非常基础而重要的课程。如此,要全面、系统地把握实验,从何谈起?而那些别的专业要做“活性”的研究生们,如果把“活性”部分交由药理方面的人员做则尚可。有的则是在没有多少了解的情况下自己动手,这样的实验结果又如何能可信呢?因此,那些没有系统学过这方面知识,但又想自己能够做一些“活性”实验的朋友们,一定先要了解一下相关的专业基础知识 | 